

A szelént 1817-ben Berzelius fedezte fel. Később felfedezték annak elektromos és optikai tulajdonságait, amelyek ösztönözték a kutatásokat az elektrofotográfiai területen. Ennek eredményeként a szelént a xerográfiai vagy fénymásolási eljárásokban kezdték alkalmazni.
Kezdetben a szelén biológiai szerepe iránt kevés érdeklődés mutatkozott, főleg toxikus tulajdonságai miatt. A szelén toxicitását először állatokban ismerték fel, amikor szarvasmarhák, amelyek szeléntartalmú talajon termesztett növényeket legeltek, egy betegséget, az úgynevezett alkalidbetegséget vagy vak tántorgást fejlesztették ki, ami végül halálhoz vezetett. Felmerült, hogy az emberekre is hatással lehet a túlzott szelénbevitel, de a szelén toxicitását emberekben nehezen ismerték fel.

A szelén iránti érdeklődés a „faktor3” nevű vegyület felfedezése révén nőtt meg, amelyről megállapították, hogy védi az állatokat a zsíros beszivárgástól és a máj elhalásától. Ez felvetette a szelén és az E-vitamin közötti kapcsolat lehetőségét. Schwarz és Foltz 1957-es kutatása kimutatta, hogy a szelénhiány specifikus rendellenességeket okozott laboratóriumi állatokban, és a szelénpótlás visszafordította a fehérizom-betegséget, amely szelénhiányos talajon nevelt juhoknál és szarvasmarháknál fordult elő. Ez arra utalt, hogy a szelén részt vesz a sejtoxidációhoz kapcsolódó enzimrendszerek kofaktoraként, és szerepe lehet az emberi táplálkozásban is.
Rotruck és munkatársai felfedezték, hogy a szelénhiány oxidatív károsodáshoz vezetett a vörösvértestekben, ami a glutation-peroxidáz nevű enzim csökkent aktivitásával állt összefüggésben. Ez az enzim csökkenti a hidrogén-peroxid káros hatását a hemoglobinra. Végül kiderült, hogy a szelén a glutation-peroxidáz enzim komponense, ami közvetlen biokémiai szerepet ad a szelénnek.
A szelénmérgezés és -hiány hatásait állatokon alaposan dokumentálták, és ezek fajonként eltérőek. A szelenózis, vagyis a szelénmérgezés leginkább kérődzőkben, illetve legelő állatokban fordul elő, amelyek szelént felhalmozó növényeket, például lófűvet fogyasztanak. Ezek a növények akkor halmozzák fel a szelént, ha az ásványi anyag nagy koncentrációban van jelen a talajban. A növények képesek a szervetlen szelént hasznosítható formává alakítani.
Elpusztulásuk után a szerves szelén visszakerül a talajba, amit más növények is felhasználhatnak. Magas szeléntartalmú talajok találhatók Észak-Amerikában, különösen a síkságokon, például Wyomingban, Dél-Dakotában, Nebraskában és Oregonban. Ezen kívül más régiókban is előfordulnak magas szeléntartalmú területek, mint Ausztrália, Izrael, Írország, Dél-Afrika, Dél-Amerika, a volt Szovjetunió, Franciaország, Németország és Kína.
Az embereknél a legismertebb szelénhiánnyal kapcsolatos betegség a Keshan-kór, egy kardiomiopátia, amely elsősorban gyermekeket és fiatal nőket érint. Ezt az állapotot Kínában fedezték fel olyan területeken, ahol a talaj alacsony szeléntartalmú. Az itt élő emberek étrendjében a fő alapanyagként fogyasztott gabonafélék is kevés szelént tartalmaztak. A szelénpótlás pozitív hatást gyakorolt a Keshan-betegségben szenvedő egyénekre.
Egy másik, szelénhiánnyal összefüggésbe hozott betegség a Kashin-Beck-kór, amely szintén alacsony szeléntartalmú területeken fordul elő, és egy osteoarthritises állapot, ami a gyermekek fejlődési időszakában jelentkezik. A betegség „nagyízületi” állapotként is ismert, mivel az érintett ízületek duzzanatával és kalciumlerakódásokkal jár. Bár a szelénhiány ezekben az állapotokban szerepet játszik, önmagában nem tekinthető az egyetlen kiváltó oknak.

Az emberi szemlencse szeléntartalma az életkorral növekszik, de a szürkehályogos lencsék szeléntartalma jelentősen csökkent. A szelénhiány miatt csökken a glutation-peroxidáz aktivitása, ami növeli az oxidatív károsodás esélyét, különösen a szürkehályog kialakulása esetén. Olyan tényezők, mint a gyógyszerek és a nehézfémek, például a higany, hozzájárulhatnak ehhez a folyamathoz.
A szelénhiány a glutation-peroxidáz csökkent aktivitásával társul, ami szerepet játszhat hemolitikus anémia és vashiányos vérszegénység kialakulásában. Az újszülötteknél, különösen a koraszülötteknél, valamint a sárgasággal küzdő csecsemőknél is alacsonyabb glutation-peroxidáz aktivitást figyeltek meg.

A szelénhiány és az öregedés közötti kapcsolatot az oxidatív stresszre adott sejtválaszok révén vizsgálták. A glutation-peroxidáz csökkent aktivitása hozzájárulhat a degeneratív öregedési folyamatokhoz, mint a korai öregedés, a lipofuscin lerakódása és a krónikus gyulladások kialakulása.
Kísérletek kimutatták, hogy a szelén csökkenti a tumorképződést, például emlőrák esetében, és lassítja a daganatok növekedését. Az alacsony szelén- és E-vitamin-szint hozzájárulhat a tüdő-, bőr- és emésztőrendszeri daganatok kialakulásához. A szelén véd a kromoszómakárosodás ellen, segíti a DNS-javítást és szabályozza a sejtosztódás sebességét.
A szelén az E-vitaminnal együtt növeli az antitestképződést, így a szelénhiány rontja az immunrendszer hatékonyságát. Alacsony szelénszinteket mutattak ki AIDS-betegeknél, és a szelénpótlás javulást eredményezett az AIDS-hez kapcsolódó kardiomiopátia esetében.
Bár ellentmondásos, egyes tanulmányok szerint a szelénhiány összefüggésbe hozható a SIDS-szel.


Vizsgálatok azt sugallják, hogy a szelénhiány kapcsolatban állhat a cisztás fibrózissal, különösen a cink- és E-vitamin-hiánnyal kombinálva. Cisztás fibrózisban szenvedő gyermekek májában szignifikánsan alacsonyabb szelénszintet mutattak ki.
A Crohn-betegséggel élő betegek körében csökkent szelén- és glutation-peroxidáz-szinteket figyeltek meg, különösen azoknál, akik jelentős bélmetszéseken estek át, ami a szelénfelszívódás csökkenéséhez vezet.

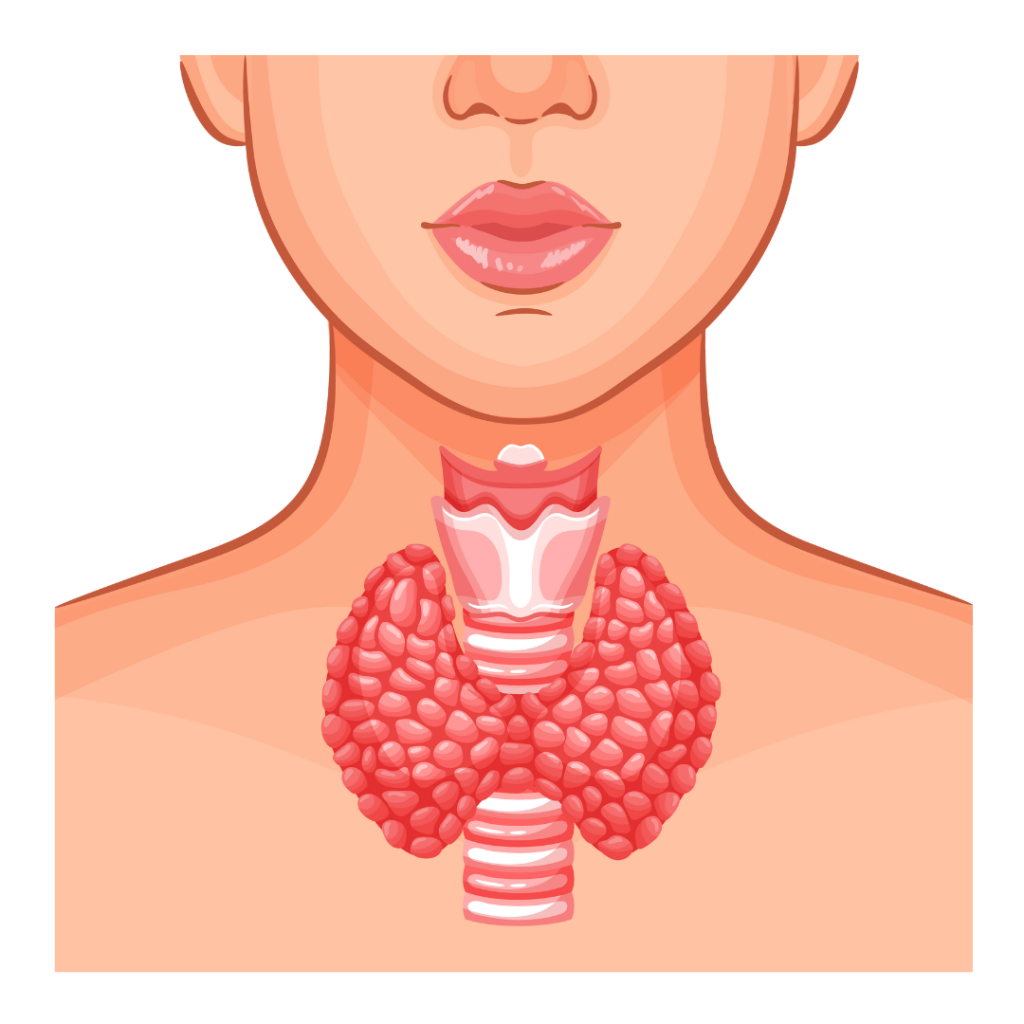
A szelén kulcsszerepet játszik a pajzsmirigy hormontermelésében. Az 1-jódtironin-dejodináz (IDI) enzim, amely a T4 átalakulását T3-má végzi, egy szelénfüggő enzim. Szelénhiány esetén az IDI aktivitása csökken, ami pajzsmirigy-alulműködéshez vezethet.
A csökkent szelénbevitel mellett számos egyéb tényező is hozzájárulhat a szelénhiány kialakulásához. Az ásványi anyagok közötti kölcsönhatások jelentős szerepet játszanak ebben a folyamatban, mivel egyes ásványi anyagok antagonisták a szelénnel szemben. Például a kén (S) megvédi a szervezetet a szelén toxicitásától. Ganther szerint a szelén és más nehézfémek, például az ezüst (Ag), arzén (As), kadmium (Cd), higany (Hg) és tallium (Tl) közötti antagonista hatás szintén jelentős. Fontos megjegyezni, hogy bár a szelén megvédi a szöveteket a nehézfémek toxikus hatásaitól, a nehézfémek kiválasztódását nem fokozza. Ehelyett a szelén megköti ezeket a fémeket, például a higanyt és a kadmiumot, így csökkenti azok káros hatásait a sejtekre és szövetekre.
A fluor (F) hatásáról kimutatták, hogy ellensúlyozza a szelenózis, azaz a szelénmérgezés hatásait. Olyan területeken, ahol magas a szelén és a fluor szintje, a szelén nagy mennyiségben sem volt mérgező, amikor fluor is jelen volt.
Schrauzer szerint az ólom (Pb), az ón (Sn) és a cink (Zn) szintén antagonista hatást gyakorolhat a szelénre.
Schrauzer szerint az ólom (Pb), az ón (Sn) és a cink (Zn) szintén antagonista hatást gyakorolhat a szelénre. Újabb vizsgálatok megerősítették a cink-szelén antagonizmust. A réz (Cu) is bizonyítottan antagonista a szelénnel szemben. A TMA-vizsgálatok (szöveti ásványianyag-elemzés) alapján feltételezhető, hogy a szelén antagonista lehet a magnéziummal is, mivel a szelén növelheti a nátriumszintet, ami fokozza a magnézium kiválasztását. A magnézium elengedhetetlen a glutation szintéziséhez, és annak hiánya súlyosbíthatja a szelénmérgezés hatásait.
A szelén vas- és mangánantagonizmust is okozhat, mivel vérszegénységet figyeltek meg szeléntoxicitásban szenvedő állatoknál és embereknél egyaránt. A szelénmérgezésben szenvedő állatoknál az A-vitamin és az aszkorbinsav szintje is csökken. Ip kutatásai szerint a szelén emlőkarcinómával szembeni védőhatása megszűnt magas C-vitamin-kiegészítés mellett. A szelénmérgezéses állatoknál csökkent a C-vitamin és a K-vitamin szintje is. Összességében a szelén túlzott felhalmozódása különféle tápanyagokat befolyásolhat, amelyek viszont gátolhatják a szelenózis toxikus hatásait.
Az E-vitamin az egyik legismertebb szinergista a szelénnel, mivel zsírban oldódó antioxidánsként védi a lipid sejtmembránokat az oxidációtól, és kiegészítése segíthet csökkenteni a szelénhiány tüneteit. A kobalt (Co) szintén szinergikus hatású lehet a szelénnel. Egy nagy mennyiségű szelént tartalmazó étrend nem okozott szeléntoxicitási tüneteket laboratóriumi állatokban, ám amikor kobaltot is hozzáadtak, megjelentek a szelenózis tünetei. A B6-vitamin is szinergista, amely segít a szelenometionin átalakításában glutation-peroxidázzá.
Bizonyos körülmények között a C-vitamin antagonista lehet a szelénnel szemben, de más esetekben fokozhatja a szelén felhasználását. Humán vizsgálatok kimutatták, hogy a C-vitamin szerepet játszik a szelén homeosztázis fenntartásában. A réz is szinergikus a szelénnel; állatkísérletekben a glutation-peroxidáz aktivitása csökkent rézhiány esetén, ami azt mutatja, hogy a réz jelenléte előnyös a szelén hatékonysága szempontjából.

A szelént kezdetben toxinnak tartották, mielőtt rájöttek, hogy nélkülözhetetlen tápanyagként is szerepet játszik. A szeléntoxicitást először Kína magas szeléntartalmú területein azonosították, de azóta az Egyesült Államokban és más országokban is felismerték.
Az ipar felelős volt a szelénmérgezés több forrásáért. A szelén ipari kitettsége két kategóriába sorolható: elsődleges és másodlagos források. Az elsődleges források közé tartozik a bányászat, az érckitermelés, valamint a mész- és cementgyártás, amelyek során a dolgozók szeléntartalmú porokkal érintkezhetnek. A másodlagos forrásokból, például az üveg- és kerámiagyártásból, valamint a gumitermékek vulkanizálásából származnak szerves szeléngőzök és füstök. Szelénvegyületek találhatók a műanyag- és elektronikai iparban, valamint festékekben és nyomdafestékekben is.
Szelénmérgezést jelentettek olyan egyéneknél is, akik szelén-tartalmú táplálékkiegészítőket szedtek, amelyek sokkal több szelént tartalmaztak, mint amennyi a címkén fel volt tüntetve. Kínában a szeléntartalmú területeken élő egyéneknél átlagosan napi 5 milligramm szelén bevitel volt jellemző, ami szeléntoxicitást okozott.
A szelénmérgezés jeleit több kutató is vizsgálta. Az ipari kitettség akut tünetei közé tartozik a szem, az orr és a torok irritációja, az orrlyukak égő érzése, tüsszögés, köhögés, vérbőség, valamint szédülés. Erősebb expozíció esetén nehézlégzés, fejfájás és az uvula duzzanata is előfordulhat. A krónikus kitettség tünetei között szerepel a hipokróm vérszegénység, leukopénia, rendszertelen menstruáció és fokhagymás lehelet vagy fémes íz.
A táplálékkiegészítőkből származó túlzott szelénfogyasztás émelygést, hányást, hajhullást, körömváltozásokat, fáradtságot, ingerlékenységet és perifériás neuropátiát okozhat. A magas szeléntartalmú területeken élők esetében émelygés, hányás, a bőr depigmentációja, hajhullás és alacsony hemoglobinszint is megfigyelhető. A szelén fogakra gyakorolt hatását állatkísérletek is igazolták, amelyek fogszuvasodást mutattak ki szelenózisos régiókban.
Érdekes módon egyes esetekben a szelenometionin helyi alkalmazása jótékony hatású volt az ultraibolya sugárzás okozta bőrrák elleni védelemben.
A gabonafélék jó szelénforrásnak tekinthetők, bár tartalmuk a talaj szeléntartalmától és az előkészítési módoktól függ. További jó források közé tartoznak a tenger gyümölcsei, a vese, a máj, a húsok és a baromfi, míg a gyümölcsök és zöldségek – kivéve a fokhagymát és a spárgát – általában alacsony szeléntartalmúak. A szervezetben a szelén legnagyobb koncentrációban a vesében és a májban található.
Az Egyesült Államokban a szelén ajánlott napi bevitele nincs hivatalosan meghatározva, de a biztonságos és megfelelő napi bevitel felnőttek számára 50-200 mikrogramm között van. Az amerikai és kanadai lakosság becsült szelénbevitele napi 62-216 mikrogramm között mozog.

Az amerikai populációkban a szelén átlagos vérkoncentrációja 20,6 µg/100 ml, a tartomány 10-34 µg/100 ml között mozgott, hasonlóan a kanadai eredményekhez. Kóros állapotok, például kwashiorkor esetén a szelénszint alacsonyabb: a betegek átlagos szintje 11 µg/100 ml volt a kontrollcsoport 23 µg/100 ml-éhez képest. Égési sérülteknél is csökkent szelénszintet figyeltek meg. Érdekes módon a vörösvérsejtek szelénszintje normális maradt a hiányos csoportokban, míg a plazma vagy a szérum szelénszintje jobban tükrözte a szelén állapotát.
Az alacsony szelénszinttel összefüggésbe hozott egyéb állapotok közé tartozik az alkoholos cirrhosis, rák, izompanaszok, magas vérnyomás, érelmeszesedés, ízületi gyulladás, izomdisztrófia, meddőség, makuladegeneráció és diabéteszes neuropátia.
A szelénhiány értékelésében hasznos eszköz a plazma vagy az eritrocita-glutation-peroxidáz szintjének mérése, mivel ez a szelénfüggő enzim jó indikátor a hiány megállapítására. Azonban ez az elemzés nem alkalmas a megfelelő vagy toxikus szintek nyomon követésére.
A haj szöveti ásványianyag-elemzését (TMA) is alkalmazták, például a Keshan-kór tanulmányozásakor, és kimutatták, hogy a haj- és a vérszelénszint szoros összefüggésben áll. A TMA különösen hasznos a szelén szintjének értékelésében, mivel lehetővé teszi annak vizsgálatát, hogy a szelén hogyan kölcsönhatásba lép más antagonistákkal és szinergista ásványi anyagokkal.
Bár a szelén egyre nagyobb figyelmet kap a táplálkozástudományban, még sok felfedeznivaló van ezzel a fontos nyomelemmel kapcsolatban. Kutatásai leginkább az antioxidáns rendszerben játszott szerepére összpontosítanak, de biológiai hatása valószínűleg ennél sokkal szélesebb körű. Ahogyan minden más tápanyagot, a szelént sem szabad önmagában vizsgálni, mivel hiánya vagy feleslege más tápanyagokra is hatással van. Ezért az egyén szelénstátuszának értékelését a szelén antagonistáinak, szinergistáinak és kofaktorainak figyelembevételével kell elvégezni.
A haj ásványi elemzése egyedülálló és átfogó betekintést nyújt az egészségi állapotába és segíti szervezete megértését. A mintavétel egyszerű és fájdalommentes, csupán néhány hajszálat igényel a fejbőr közeléből. A páciens nem csak egy leletet kap kézhez, hanem egy személyre szabott jelentést is, ami magában foglalja az ajánlásokat a táplálkozási és életmódbeli változtatásokra, illetve szükség esetén táplálékkiegészítőkre vonatkozóan, hogy a páciens javíthassa ásványianyag-egyensúlyát és csökkentse a toxikus fémek hatásait.

Forrás: David L. Watts, D.C., Ph.D., F.A.C.E.P.i.
Referenciák:
10.Cirelli A, et al: Serum selenium concentration and disease progress in patients with HIV infection. Clin. Biochem. 24: 211-214, 1991.
13.Wallach JD: Cystic fibrosis: A proposal of etiology and pathogenesis. Quantum Med. 1.2: 1-48, 1988.
14.Rannem T, et al: Selenium status in patients with Crohn’s disease. Am. J. Clin. Nutr. 56:933-937, 1992.
15.Aaseth J, Aadland E, Thomassen Y: Serum selenium in patients with short bowel syndrome. Selenium in biology and medicine part B. Combs, Spallholz, Levander, Oldfield, Eds. AVI, NY. 976- 980, 1987.
17.Goodhart RS, Shils ME: Modern nutrition in health and disease. Lea and Fediger, Phil. 392-393, 1976.
18.Ganther HE: Biochemistry of selenium. Selenium. Zingaro, Copper, Eds. VNR, NY. 546-614, 1974.
19.Bian-Sheng L, Shen-Si L: Endemic selenosis and fluorosis. Selenium in biology and medicine part B. Combs, Spallholz, Levander, Oldfield, Eds. AVI, NY. 708-711, 1987.
23.Minnich V, et al: Glutathione biosynthesis in human erythrocytes. Identification of the enzymes of glutathione synthesis in hemo-lysates. J. Clin. Invest. 50: 507-513, 1971.
24.Yan L, Boylan M, Spallholz, JE: Effect of dietary selenium and magnesium on human mammary tumor growth in athymic nude mice. Nut. Cancer 16: 239-248, 1991.
25.Fishbein L: Toxicology of selenium and tellurium. Toxicology of trace elements. Goyer, Mehlman, Eds. John Wiley, NY. 191-240, 1977.
30.Martin RF, et al: Ascorbic acid-selenite interactions in human studies with an oral dose of 74Se03 2 -. Am. J. Clin. Nutr. 49: 862-869, 1989.
33.Zidenberg-Cherr S, Keen CL: Essential trace elements in antioxidant processes. Trace elements, micronutrients, and free radicals. Dreosti JE, Ed. Humana Press, NJ. 107-127, 1991.
35.Fishbein L: Toxicology of selenium and tellurium. Toxicology of trace elements. Goyer RA, Mehlman MA, Eds. Wiley and Sons, NY. 191-240, 1977.
44.Levander OA: Selenium: Biochemical action, interactions and some human health implications. Clinical, biochemical and nutritional aspects of trace elements. Prasad AS, Ed. AR Liss, NY. 345- 368, 1982.
45.Ganther HE: Biochemistry of selenium. Selenium. Zingaro RA, Copper WC, Eds. VNR, NY. 546- 614, 1974.
46.Prasad AS: Trace elements and iron in human metabolism. Plenum Pub., NY. 234, 1978.